近日,我校生命科学与技术学院刘畅教授团队在国际著名期刊Advanced Materials(IF=29.40)、Cell Death & Disease(IF=9.20)和Molecular Metabolism(IF=8.140)发表系列长文,就胶质瘤的纳米材料靶向干预、肝癌发生的时辰调控机理及褐色脂肪能量代谢时空稳态维持机制展开了深入研究。
在肿瘤靶向治疗方面,该团队通过高通量药物筛选平台从1430个小分子化合物中筛选得到一种新型抗神经胶质母细胞瘤(GBM)药物洛美他派(LMP)。此外,他们构建了一种主动靶向GBM的仿生纳米给药系统(RFA-NP),该系统主要以负载LMP四面体DNA纳米笼(tFNA-NP)为核心、以叶酸修饰的红细胞-癌细胞-巨噬细胞杂化膜(FRUR)为外壳所组成。结果表明,LMP-RFA-NPs在荷瘤小鼠中表现出优越的抗GBM活性,减少脱靶效应,显著延长GBM模型小鼠的寿命,并且副作用可以忽略不计。该研究将高通量药物筛选与仿生纳米给药系统技术相结合,为GBM治疗的药物开发和临床治疗策略优化提供了理论和实践依据。该研究发表在Advanced Materials期刊上,宋明明博士后和2022级硕士研究生田嘉甍为并列第一作者,刘畅教授为通讯作者,我校为唯一通讯单位(全文链接:https://doi.org/10.1002/adma.202311760)。
另一方面,生物钟调控生理稳态机制是刘畅/陈思禹教授课题组的传统研究方向。近期他们发现,DNA聚合酶β(POLB)作为DNA碱基切除修复(BER)途径中的关键酶,在小鼠肝脏中呈现昼夜节律性表达。肝脏POLB能通过去甲基化时钟基因Per1 5’UTR上第4个CpG岛,以E-box非依赖的方式,诱导Per1 mRNA表达,加剧肝细胞癌(HCC)进程。临床上,POLB在临床HCC样本中的表达水平与不良预后呈正相关。该发现揭示了POLB驱动的BER系统在承接时钟和食物信号,调控HCC发生发展过程中的重要作用,并揭示了POLB以非经典的方式调控时钟基因表达稳态的内在机制。该研究发表在Cell Death & Disease期刊上,陈思禹教授和张雯翔副教授为并列第一作者,刘畅教授为通讯作者,我校为唯一通讯单位(全文链接:https://www.nature.com/articles/s41419-024-06462-7)。
在代谢稳态调控方面,该团队研究发现,在肥胖模型小鼠的褐色脂肪组织(BAT)中,泛酰巯基乙胺酶Vanin-1的表达显著降低。Vanin-1缺乏导致肥胖易感性增加、BAT功能障碍以及线粒体结构异常,并促进BAT白色化。这主要归因于线粒体电子传输链受损、线粒体呼吸效率减慢。反之,Vanin-1的过表达显著增强BAT的能量消耗和产热能力,抵抗高脂食物诱导的肥胖发生。此外,半胱胺治疗可挽救Vanin-1-/-小鼠的线粒体功能障碍。因此,Vanin-1在促进线粒体呼吸氧化以及对抗饮食诱导的肥胖方面发挥着至关重要的作用,有望成为肥胖治疗的潜在靶点。该研究发表在Mol Metab期刊上,我校已毕业博士研究生孙琛(现就职于山东第二医科大学)及2021级硕士研究生梁佳琦为并列第一作者,刘畅教授为并列通讯作者,我校为通讯单位(全文链接:https://doi.org/10.1016/j.molmet.2024.101884)。
以上工作获得国家自然科学基金重大研究计划培育项目、国家重点研发计划项目、江苏省自然科学基金、新疆维吾尔自治区自然科学基金以及中国药科大学多靶标天然药物全国重点实验室研究项目的资助。
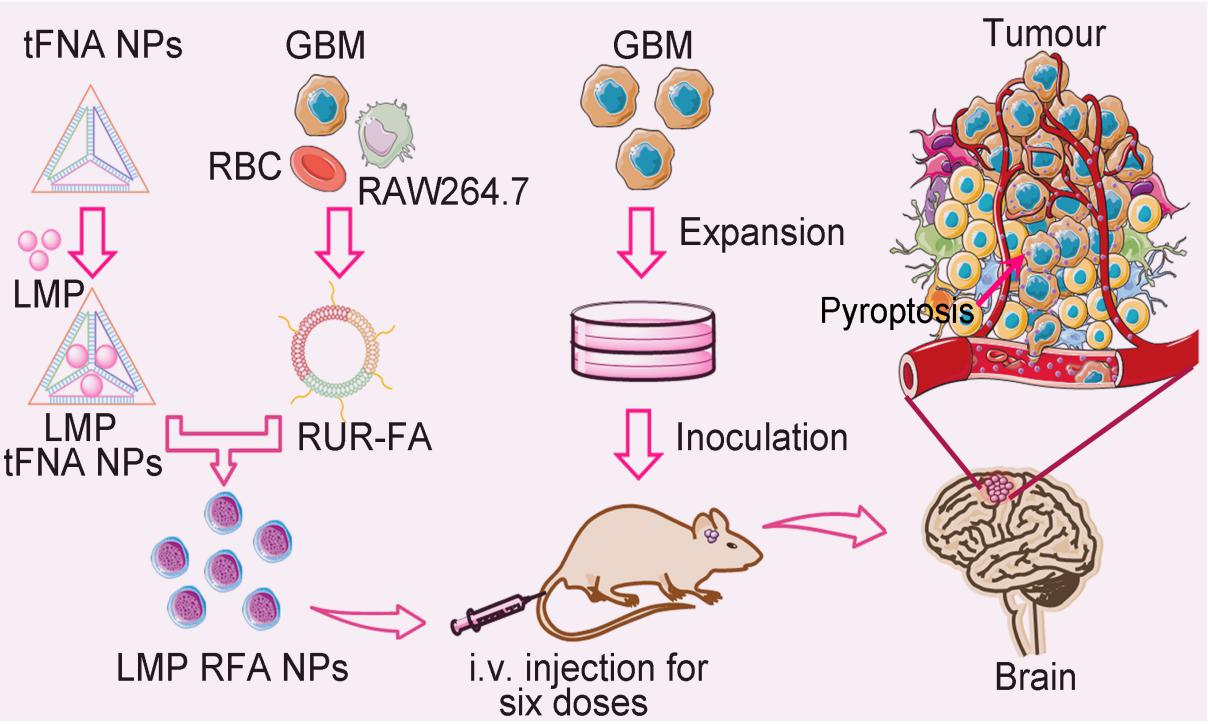
图1

图2

图3



